Résumé
Les Lépidoptères (Lepidoptera) sont un ordre d'insectes holométaboles dont la forme adulte (ou imago) est communément appelée papillon, dont la larve est appelée chenille, et la nymphe chrysalide. Il s'agit d'un des ordres d'insectes les plus répandus et les plus largement connus dans le monde, comprenant entre décrites (dont près de 7,000 en Europe et 5,000 en France ) réparties dans 136 familles et 43 super-familles. Les plus anciennes traces fossiles de papillons montrent que ces insectes ailés vivaient déjà sur la planète il y a 201 millions d’années, au côté des premiers dinosaures. Ils se caractérisent à l'état adulte par trois paires de pattes (comme tous les insectes) et par deux paires d'ailes recouvertes d’écailles de couleurs très variées selon les espèces. Ils pondent des œufs qui donnent naissance à des chenilles. Ces dernières se transforment ensuite en chrysalides (s'abritant ou non dans un cocon préalablement tissé). Il en émerge enfin l'imago, ou papillon. Leur cycle biologique se trouve donc composé de quatre stades distincts : œuf, chenille, chrysalide et papillon. Ce sont des insectes à métamorphose complète. Comme les abeilles et la plupart des pollinisateurs, dans une grande partie du monde, les papillons sont en forte régression, principalement en raison de l'intensification de certaines pratiques de l'agriculture (monocultures, pesticides) et, localement, de la mortalité routière et de la pollution lumineuse ; ainsi, la mise à jour 2016 de la liste rouge de l'UICN montre que pour 462 espèces de papillons indigènes évaluées en zone méditerranéenne, 19 sont menacées d'extinction (dont 15 endémiques de cette écorégion).
Étymologie
Le terme « lépidoptère » dérive du latin scientifique lepidoptera, terme construit lui-même à partir du grec ancien λεπίς « écaille » et πτερόν « aile »). Bon nombre d’espèces sont désignées par un nom vernaculaire différent suivant leur stade de développement. Souvent seul le papillon est nommé, parfois, seule la chenille, car ravageuse, porte un nom. Plus exceptionnellement, les deux formes sont nommées, comme pour les espèces Morio (Nymphalis antiopa) ou Bombyx du mûrier (Bombyx mori). Le mot « papillon » est dérivé du latin . En nahuatl, papillon se dit papalotl, ce qui a donné naissance au mot papalote : cerf-volant,. Voir : liste de, de et de .

Métamorphose
Les Lépidoptères sont des holométaboles comme les diptères ou les coléoptères. Au stade de l'imago, le papillon a une longévité variable selon l'espèce, de quelques jours (Bombyx du mûrier) ou semaines (Flambé, Machaon) à plusieurs mois (jusqu'à dix pour le Citron Gonepteryx rhamni).
Ailes
Les Lépidoptères, sous la forme adulte (papillon), sont caractérisés par deux paires d'ailes membraneuses recouvertes d’écailles colorées, qui sont des soies aplaties ; le mot « lépidoptère » vient de cette caractéristique : lepidos veut dire « écaille » en grec et pteros, « aile ». Une écaille alaire est une minuscule plaque chitineuse le plus souvent pigmentée dotée d'un pédicelle à sa base permettant son insertion sur la membrane. Certaines couleurs métalliques sont optiques par diffraction de la lumière (cas par exemple pour l'Europe du genre Apatura Grand mars changeant, Petit mars changeant). Chez les papillons, les dessins et les couleurs alaires ont des fonctions multiples, comme la thermorégulation, l'évitement de la prédation et la reproduction. Parmi ces fonctions, le camouflage, l'aposématisme et le mimétisme sont phylogénétiquement très répandus et présentent une grande diversification évolutive. La sélection naturelle privilégie les espèces qui réalisent le meilleur compromis évolutif (trade-off dans la littérature scientifique) d’allocation des ressources entre ces différents traits d'histoire de vie,. Des écailles spécialisées, qui forment les androconies, sont présentes sur la face supérieure des ailes des mâles et diffusent des phéromones sexuelles, notamment la danaidone, issues de glandes lors des parades nuptiales. Les ocelles ou yeux peuvent être des ornementations de défense (chez le Paon du jour par exemple), c'est un bon moyen de reconnaissance des espèces (comme l'ocelle orange centré de noir à l'aile antérieure du Petit mars changeant absent chez le Grand mars changeant ). Le revers brun ou noir de ses ailes présente souvent une livrée homochrome qui permet de se cacher à de nombreuses espèces présentant des couleurs vives sur le recto de leurs ailes (Paon du jour par exemple). Certaines espèces présentent la particularité de ne porter que très peu d'écailles : cas du genre Cithaerias. Les papillons sont des organismes héliophiles et souvent thermophiles, leurs ailes jouant un rôle de thermorégulation afin d'optimiser l'efficacité de leurs activités (vol, recherche de nourriture). Au repos, posé à l'ombre, l'échauffement est un processus endothermique et se manifeste par de rapides frémissements des ailes assez proches dans leur principe du frissonnement. Au repos par temps ensoleillé, ils orientent les ailes par rapport aux rayons du soleil en fonction de la température ambiante (processus exothermique). Par temps frais et peu ensoleillé, ils adoptent la posture dorsale (ailes étalées comme celles d'un avion : ouverture totale ≥ 180°, partielle < 180°), prenant de véritables bains de soleil. Au contraire, lors de journées chaudes et ensoleillées, ils adoptent la posture latérale (ailes plaquées verticalement l'une contre l'autre au-dessus du corps) de façon à limiter la surface exposée aux rayons. Ils se protègent également de la surchauffe thoracique en volant énergiquement de place en place pour limiter le temps d'exposition. Certains grands papillons de jour (comme le Flambé ou le Machaon) alternent entre des phases de vol actif avec battements d'ailes et des phases de vol plané, ces dernières évitant également la surchauffe thoracique. L'hypothèse du réchauffement corporel par un mécanisme direct (ailes absorbant directement le rayonnement du soleil et transmettant la chaleur au thorax via l'hémolymphe est infirmée par les calculs et expérimentalement, la membrane alaire étant assez mauvaise conductrice de chaleur et la circulation de l'hémolymphe trop faible,. L'hypothèse privilégiée est un mécanisme indirect : la chaleur émise par le rayonnement solaire est transférée au thorax par les ailes qui agissent comme des déflecteurs de chaleur par convection, leur angle plus ou moins ouvert favorisant la concentration du flux solaire sur la face dorsale du thorax. Les bandes claires sur les ailes jouent également un rôle thermorégulateur : elles permettent à des papillons de réduire le stress thermique dans des environnements très chauds.

Vision
En raison de la structure de leur œil multiple, les papillons ont une vision probablement moins nette que celle d'un être humain, mais bien plus performante selon d'autres points de vue : - leur champ visuel est bien plus large ; - ils perçoivent mieux que nous les mouvements rapides dans leur environnement ; - ils distinguent parfaitement l'ultraviolet et la lumière polarisée ; - ils différencient probablement beaucoup mieux les couleurs, notamment pour certaines espèces ; ainsi, le papillon Graphium sarpedon connu pour porter des marques colorées (bleu-vert, rouges) très vives présente pour chaque œil au moins 15 types de cellules photoréceptrices, contre 4 chez la plupart des autres insectes. Des expérimentations physiologiques, anatomiques et moléculaires ont porté sur 200 mâles de cette espèce (plus faciles à capturer que les femelles), qui ont confirmé que chacun de ces photorécepteurs était sensible à une partie du spectre lumineux solaire. Trois récepteurs sont dédiés aux bleus et quatre aux verts.
Corps
Leur corps est souvent caché par un épais revêtement de phanères. Leurs pièces buccales sont transformées en proboscis (sauf chez certains petits groupes très primitifs pour ce caractère, tels les Micropterigidae munis de mandibules broyant le pollen), trompe enroulée en spirale au repos, pour aspirer le nectar. La trompe est formée par les galeas des maxilles qui sont fortement allongées et reliées entre elles par deux coaptations : l’antérieure formée de soies et la postérieure formée de crochets qui les solidarisent fortement, formant ainsi un canal qui permet l’aspiration du nectar. Toutes les autres pièces buccales sont atrophiées ou absentes, à l’exception des palpes labiaux qui protègent la trompe lorsqu’elle est enroulée au repos. La trompe des papillons est un outil de haute précision qui cumule les prouesses techniques. Au repos, elle reste enroulée en spirale comme un ressort de montre, sous l'effet d'une lame élastique qui court tout au long de sa paroi supérieure. Une succession d'anneaux de chitine - substance très résistante - maintient la canalisation béante quelle que soit sa courbure. Lorsque le papillon veut se nourrir, il contracte une série de plusieurs centaines de minuscules muscles obliques, situés dans l'épaisseur de la trompe, dont ils provoquent le déroulement. Au premier tiers de la longueur, des muscles spéciaux coudent la trompe vers le bas. Cette articulation souple favorise en particulier la recherche du nectar dans les corolles les plus étroites et les plus profondes. Sans même avoir à baisser la tête, le papillon déplace sa trompe pour explorer tous les recoins des fleurs qu'il visite. Dans la tête de l'insecte, une sorte de poire peut se dilater sous l'action de muscles puissants. Elle fait office d'aspirateur. Grâce à des organes gustatifs très sensibles situés au bout de leurs pattes, ils savent immédiatement s'il y a lieu de déployer leur encombrant attirail d'aspiration. 99 % des espèces connues sont phytophages, c’est-à-dire se nourrissent de plantes. Les adultes se nourrissent pour la plupart de nectar des plantes à fleurs. Certains ont les pièces buccales classiques des Insectes, ce qui est un caractère primitif, d’autres ont une trompe atrophiée et ne se nourrissent pas à l’état adulte.
Variabilité
Chaque espèce de Lépidoptères peut présenter différents types de variabilité. Il existe des variations de taille, les individus pouvant être plus ou moins grands en fonction de la génération, de l'altitude ou encore du climat. Il existe également des variations, parfois très importantes, dans l'ornementation alaire : - Dimorphisme sexuel : beaucoup d'espèces présentent des différences entre le mâle et la femelle, différences souvent minimes, mais qui peuvent aller chez certaines espèces jusqu'à une coloration ou ornementation totalement différente. C'est le cas de nombreux Azurés, comme l'Azuré commun (Polyommatus icarus). - Indépendamment de tous ces facteurs, il existe toujours une certaine variabilité individuelle, deux papillons n'étant jamais identiques.
Histoire évolutive
La forme actuelle des stades de développement, de l'œuf à l'imago, existe sans doute depuis 150 Ma. Les 220000 espèces vivent partout dans le monde excepté dans l'Antarctique et sont particulièrement nombreuses dans la région des tropiques. Elles sont presque toujours associées à des plantes supérieures (des angiospermes ou plantes à fleurs) et ont donc coévolué. Il est en effet vraisemblable que l'évolution qui a conduit à ce groupe qui possède un organe hautement spécialisé comme la trompe s’est accomplie en même temps que le développement des plantes à fleurs avant la fin du Tertiaire. Comme presque toutes les espèces ont des chenilles inféodées à une plante-hôte précise, l'évolution n'a sûrement dû se faire qu'en présence d'une seule plante-hôte ancestrale, donc pas avant le Tertiaire.
Fossiles
Les Lépidoptères fossiles ont tendance à être plus rares que ceux des autres insectes, parce qu’ils étaient moins abondants dans des types d'environnement comme les lacs et les étangs propices à la fossilisation et que les stades larvaires n’ont que la tête chitineuse comme partie dure susceptible d'être fossilisée. Il existe cependant quelques fossiles, dans l’ambre ou dans des sédiments très fins. Des traces de galeries peuvent être observées sur des feuilles fossiles mais leur interprétation est délicate. Le fossile le plus ancien Archaeolepis mane, issu de roches britanniques, a été daté d’environ 190 Ma, au jurassique. Ce sont des restes d’ailes qui montrent des écailles à cannelures parallèles sous microscope électronique et le réseau de nervures caractéristique commun aux Lépidoptères et Trichoptères. On ne connaît que deux autres fossiles du jurassique et treize du crétacé. La période suivante, le tertiaire, est beaucoup plus riche en fossiles. L’éocène en particulier, avec les gisements d’ambre de la Baltique est riche. Ceux-ci ne sont pas d’une grande utilité pour établir la phylogénie des Lépidoptères car ils sont déjà très proches des espèces modernes. Plus rarement, les Lépidoptères peuvent se trouver dans des sédiments de type lacustre : diatomite. Un bel exemple a été publié dans le Bulletin des lépidoptères de France. D'après les fossiles du Jurassique d'Amphiesménoptères découverts (groupe constitué des ancêtres des Trichoptères et Lépidoptères, selon la classification de Willi Hennig), ces groupes se sont différenciés il y 56 Ma.


Position au sein des insectes
Les Lépidoptères sont un ordre. Au sein de la classe des insectes, celui-ci est placé dans la sous-classe des ptérygotes, l'infra-classe des néoptères et le super-ordre des holométaboles (ou endoptérygotes, qui se caractérisent par leur cycle de développement à métamorphose complète). L'étude des relations de parenté (phylogénie) entre les différents ordres d'insectes montre que les Lépidoptères sont le groupe frère de l'ordre des Trichoptères.
Historique
Carl von Linné dans Systema Naturae (1758) reconnaît trois groupes de Lépidoptères : les Papilio, les Sphinx et les Phalaena avec sept sous-groupes dans les Phalaena (Scoble, 1995). Cette séparation se retrouve aujourd’hui dans 9 des super-familles de Lépidoptères. Après Linné, Denis et Schiffermüller (1775) sont suivis par Fabricius (1775) et Latreille (1796). Ils identifient beaucoup plus d’espèces en les regroupant dans ce qui sera reconnu comme des genres. Hübner décrit beaucoup des genres modernes et Ochsenheimer et Friedrich Treitschke (1776-1842), dans une série de volumes sur la faune de Lépidoptères européens publiés entre 1807 et 1835, renforcent les fondements de leur classification en genres (Scoble, 1995). G.A.W. Herrich-Schaffer (plusieurs volumes, 1843-1856), et Edward Meyrick (1895) basent leur classification sur le nervurage des ailes. Au même moment, Sir George Hampson travaille sur la distinction entre Microlepidoptera et Macrolepidoptera. Parmi les premiers entomologistes à étudier les fossiles d’insectes et leur évolution, Samuel Hubbard Scudder (1837-1911) travaille sur les papillons. Il publiera une étude des gisements du Colorado. Andrey Vasilyevich Martynov (1879-1938) met en évidence la proximité des Lépidoptères et des Trichoptères (Grimaldi et Engel, 2005). Parmi les apports majeurs du figure la séparation basée sur la structure de l’appareil génital des femelles en Monotrysia et Ditrysia par Carl Julius Bernhard Börner (1880-1953) en 1925 et 1939 (Scoble, 1995). Willi Hennig (1913-1976) développe l’analyse cladistique et l’applique à la phylogénie des insectes. Niels P. Kristensen, E. S. Nielsen et D.R. Davis étudient les relations entre les familles de Monotrysia, Kristensen ayant travaillé sur la phylogénie des insectes et des grands groupes de Lépidoptères (Scoble 1995, Grimaldi et Engel, 2005). Alors qu’en général, les phylogénies basées sur les analyses de l’ADN diffèrent des phylogénies basées sur les analyses morphologiques, ce n'est pas le cas pour les Lépidoptères, au moins à grande échelle (Grimaldi et Engel, 2005). Les tentatives de regroupement des super-familles de Lépidoptères en grand groupes naturels ont toutes échoué car les critères actuels Microlepidoptera et Macrolepidoptera, Heterocera et Rhopalocera, Jugatae et Frenatae, Monotrysia et Ditrysia (Scoble, 1995) ne permettent pas de définir des groupes monophylétiques.
Classifications traditionnelles
Ces classifications étaient basées essentiellement sur des caractères superficiels. Elles ont progressivement été abandonnées au profit d’analyses phylogénétiques fondées sur des critères morphologiques et moléculaires. Dans une de ces classifications, les Lépidoptères se divisaient en : Dans une autre classification, les Lépidoptères étaient divisés en quatre sous-ordres : - la division des Ditrysia, qui représentait 99 % des Lépidoptères, elle-même divisée en deux sous-ordres : - Les Hétérocères, sont le plus souvent de couleurs ternes, leurs antennes sont souvent filiformes ou plus ou moins plumeuses (elles sont impliquées dans la communication par les phéromones). Ils sont traditionnellement considérés comme les « papillons de nuit » mais cette classification est désuète car beaucoup comme les ne sont actifs que le jour . Ce sous-ordre comprenait de nombreuses super-familles et familles qui regroupent les phalènes (à peu près 20 % des Lépidoptères), les noctuelles (plus de 30 %), les bombyx, les pyrales, les tordeuses, les teignes et les « mites » au sens large (plus de 50 %)… ; ce n'est pas un regroupement naturel, comme son nom l'indique (« les autres… ») et il doit être abandonné. - Les rhopalocères, sont des insectes aux couleurs parfois vives, leurs antennes se terminent « en massue » bien distincte (comme le terme grec rhopalos l'indique). Ils sont traditionnellement considérés comme les « papillons de jour » . Ce sous-ordre comprenait deux super-familles et plusieurs familles. - Le 1 % restant était constitué par la division des Monotrysia qui comprenait 2 super-familles caractérisées par des larves mineuses. - Frenatae - frenates - Jugatae - Macrolepidoptera - Microlepidoptera
.jpg)
Classification phylogénétique
Une nouvelle classification phylogénétique s'est progressivement développée, qui n’est pas entièrement adoptée et fait l’objet d’une révision continue (toutes les analyses moléculaires n’ont pas encore été faites, pour plus d’informations sur la classification lire l’article sur la systématique). Outre qu'il y a encore des désaccords sur certaines espèces, il est parfois délicat d'établir l'appartenance d'un papillon à une espèce ou à une autre, à cause du phénomène d'hybridation ou parce qu'un nom d'espèce couvre parfois en réalité plusieurs sous-espèces morphologiquement très proches et non encore identifiées en tant qu'espèces. Ces deux phénomènes sont plus fréquents que ne l'indiquent les guides de naturalistes. Les taxonomistes ne prennent pas en compte des individus « douteux » (probablement des hybrides le plus souvent), parce que ces derniers rendent plus difficile la discrimination des espèces. L'hybridation naturelle se produirait entre environ 10 % de toutes les espèces animales, assez rarement en moyenne, mais avec des taux d'hybridation qui peuvent être plus importants pour certaines espèces (Mallet, 2005). Les données disponibles pour les papillons d'Europe (l'un des plus étudiés dans le monde) laissent penser qu'environ 16 % des 440 espèces de papillons européens sont connus pour hybrider dans la nature avec au moins une autre espèce proche de la leur. Parmi ceux-ci peut-être la moitié ou plus sont fertiles et ont montré des preuves de « rétrocroisements » dans la nature. Une vaste synthèse publiée dans la revue Zootaxa en 2011 aboutit à la taxinomie suivante : - Lépidoptères fossiles non classés (4 familles et 12 genres) - sous-ordre des Zeugloptera Chapman, 1917 — Papillons les plus primitifs, à mandibules, 160 espèces décrites, principalement originaires du Paléarctique et du Pacifique. - super-famille des Micropterigoidea Herrich-Schäffer, 1855 (1 famille) - sous-ordre des Aglossata Speidel, 1977 — Papillons primitifs, 2 espèces décrites, originaires du Pacifique sud. - super-famille des Agathiphagoidea Kristensen, 1967 (1 famille) - sous-ordre des Heterobathmiina Kristensen & Nielsen, 1983 — Papillons primitifs, pollinivores, 3 espèces décrites, originaires d'Amérique du Sud. - super-famille des Heterobathmioidea Kristensen & Nielsen, 1979 (1 famille) - sous-ordre des Glossata Fabricius, 1775 — Papillons « classiques » pourvus d'une trompe ; groupe contenant l'immense majorité des espèces de Lépidoptères décrites (plus de 157000 espèces). - infra-ordre des Dacnonypha Hinton, 1946 - super-famille des Eriocranioidea Rebel, 1901 (1 famille) - clade des Coelolepida Nielsen & Kristensen, 1996 - infra-ordre des Acanthoctesia Minet, 2002 - super-famille des Acanthopteroctetoidea Davis, 1978 (1 famille) - infra-ordre des Lophocoronina Common, 1990 - super-famille des Lophocoronoidea Common, 1973 (1 famille) - clade des Myoglossata Kristensen & Nielsen, 1981 - infra-ordre des Neopseustina Davis & Nielsen, 1980 - super-famille des Neopseustoidea Hering, 1925 (1 famille) - clade des Neolepidoptera Packard, 1895 - infra-ordre des Exoporia Common, 1975 - super-famille des Mnesarchaeoidea Eyer, 1924 (1 famille) - super-famille des Hepialoidea Stephens, 1829 (5 familles) - infra-ordre des Heteroneura Tillyard, 1918 - clade des Nepticulina Meyrick, 1928 - super-famille des Nepticuloidea Stainton, 1854 (2 familles) - clade des Eulepidoptera Kiriakoff, 1948 - clade des Incurvariina Börner, 1939 - super-famille des Andesianoidea Davis & Gentili, 2003 (1 famille) - super-famille des Adeloidea Bruand, 1850 (5 familles) - clade des Etimonotrysia Minet, 1984 - super-famille des Palaephatoidea Davis, 1986 (1 famille) - super-famille des Tischerioidea Spuler, 1898 (1 famille) - clade des Ditrysia Börner, 1925 — contient environ 98 % des espèces de Lépidoptères décrites. - 1 famille et 25 genres non classés - super-famille des Tineoidea Latreille, 1810 (3 familles) - super-famille des Gracillarioidea Stainton, 1854 (3 familles) - super-famille des Yponomeutoidea Stephens, 1829 (10 familles) - clade des Apoditrysia Minet, 1983 - 2 familles non classées - super-famille des Simaethistoidea Minet, 1991 (1 famille) - super-famille des Gelechioidea Stainton, 1854 (21 familles) - super-famille des Alucitoidea Leach, 1815 (2 familles) - super-famille des Pterophoroidea Latreille, 1802 (1 famille) - super-famille des Carposinoidea Walsingham, 1897 (2 familles) - super-famille des Schreckensteinioidea Fletcher, 1929 (1 famille) - super-famille des Epermenioidea Spuler, 1910 (1 famille) - super-famille des Urodoidea Kyrki, 1988 (1 famille) - super-famille des Immoidea Common, 1979 (1 famille) - super-famille des Choreutoidea Stainton, 1858 (1 famille) - super-famille des Galacticoidea Minet, 1986 (1 famille) - super-famille des Tortricoidea Latreille, 1802 (1 famille) - super-famille des Cossoidea Leach, 1815 (7 familles) - super-famille des Zygaenoidea Latreille, 1809 (12 familles) - clade des Obtectomera Minet, 1986 - super-famille des Whalleyanoidea Minet, 1991 (1 famille) - super-famille des Thyridoidea Herrich-Schäffer, 1846 (1 famille) - super-famille des Hyblaeoidea Hampson, 1903 (1 famille) - super-famille des Calliduloidea Moore, 1877 (1 famille) - super-famille des Papilionoidea Latreille, 1802 (7 familles) - super-famille des Pyraloidea Latreille, 1809 (2 familles) - super-famille des Mimallonoidea Burmeister, 1878 (1 famille) - clade des Macroheterocera Chapman, 1893 - super-famille des Drepanoidea Boisduval, 1828 (3 familles) - super-famille des Lasiocampoidea Harris, 1841 (1 famille) - super-famille des Bombycoidea Latreille, 1802 (10 familles) - super-famille des Geometroidea Leach, 1815 (5 familles) - super-famille des Noctuoidea Latreille, 1809 (6 familles)
Liste des familles
- Acanthopteroctetidae Davis, 1978 (2 genres, 5 espèces) - Adelidae Bruand, 1850 (5 genres, 294 espèces) - Agathiphagidae Kristensen, 1967 (1 genre, 2 espèces) - Aididae Schaus, 1906 (2 genres, 6 espèces) - Alucitidae Leach, 1815 (9 genres, 216 espèces) - Andesianidae Davis & Gentili, 2003 (1 genre, 3 espèces) - Anomosetidae Tillyard, 1919 (1 genre, 1 espèce) - Anthelidae Turner, 1904 (9 genres, 94 espèces) - Apatelodidae Neumoegen & Dyar, 1894 (10 genres, 145 espèces) - †Archaeolepidae Whalley, 1985 (1 genre, 1 espèce) - Argyresthiidae Bruand, 1850 (1 genre, 157 espèces) - Attevidae Mosher, 1916 (1 genre, 52 espèces) - Autostichidae Le Marchand, 1947 (72 genres, 638 espèces) - Batrachedridae Heinemann & Wocke, 1876 (10 genres, 99 espèces) - Bedelliidae Meyrick, 1880 (1 genre, 16 espèces) - Blastobasidae Meyrick, 1894 (24 genres, 377 espèces) - Bombycidae Latreille, 1802 (26 genres, 185 espèces) - Brachodidae Agenjo, 1966 (14 genres, 137 espèces) - Brahmaeidae Swinhoe, 1892 (7 genres, 65 espèces) — inclut les ex-Lemoniidae. - Bucculatricidae Fracker, 1915 (4 genres, 297 espèces) - Callidulidae Moore, 1877 (7 genres, 49 espèces) - Carposinidae Walsingham, 1897 (19 genres, 283 espèces) - Carthaeidae Common, 1966 (1 genre, 1 espèce) - Castniidae Boisduval, 1828 (34 genres, 113 espèces) - Cecidosidae Bréthes, 1916 (5 genres, 16 espèces) - Choreutidae Stainton, 1858 (18 genres, 406 espèces) - Cimeliidae Chrétien, 1916 (2 genres, 6 espèces) - Coleophoridae Bruand, 1850 (5 genres, 1386 espèces) - Copromorphidae Meyrick, 1905 (9 genres, 43 espèces) - Cosmopterigidae Heinemann & Wocke, 1876 (135 genres, 1792 espèces) - Cossidae Leach, 1815 (151 genres, 971 espèces) - Crambidae Latreille, 1810 (1020 genres, 9655 espèces) - Cyclotornidae Meyrick, 1912 (1 genre, 5 espèces) - Dalceridae Dyar, 1898 (11 genres, 80 espèces) - Depressariidae Meyrick, 1883 — inclut les ex-Ethmiidae. - Doidae Donahue & Brown, 1987 (2 genres, 6 espèces) - Douglasiidae Heinemann & Wocke, 1876 (2 genres, 29 espèces) - Drepanidae Boisduval, 1828 (122 genres, 660 espèces) - Dudgeoneidae Berger, 1958 (6 genres, 57 espèces) - Elachistidae Bruand, 1850 (161 genres, 3201 espèces) — inclut les ex-Agonoxenidae. - Endromidae Boisduval, 1828 (12 genres, 59 espèces) — inclut les ex-Mirinidae. - †Eolepidopterigidae Rasnitsyn, 1983 (1 genre, 1 espèce) - Epermeniidae Spuler, 1910 (10 genres, 126 espèces) - Epicopeiidae Swinhoe, 1892 (9 genres, 20 espèces) - Epimarptidae Meyrick, 1914 (1 genre, 4 espèces) - Epipyropidae Dyar, 1903 (9 genres, 32 espèces) - Erebidae Leach, 1815 (1760 genres, 24569 espèces) — inclut les ex-Arctiidae, les ex-Lymantriidae et d'anciens Noctuidae. - Eriocottidae Spuler, 1898 (6 genres, 80 espèces) - Eriocraniidae Rebel, 1901 (5 genres, 29 espèces) - Eupterotidae Swinhoe, 1892 (53 genres, 339 espèces) - Euteliidae Grote, 1882 (29 genres, 520 espèces) - Galacticidae Minet, 1986 (3 genres, 19 espèces) - Gelechiidae Stainton, 1854 (500 genres, 4700 espèces) - Geometridae Leach, 1815 (2002 genres, 23002 espèces) - Glyphipterigidae Stainton, 1854 (28 genres, 535 espèces) — inclut les ex-Acrolepiidae. - Gracillariidae Stainton, 1854 (101 genres, 1866 espèces) - Hedylidae Guenée, 1858 (1 genre, 36 espèces) - Heliodinidae Heinemann & Wocke, 1876 (13 genres, 69 espèces) - Heliozelidae Heinemann & Wocke, 1876 (12 genres, 123 espèces) - Hepialidae Stephens, 1829 (62 genres, 606 espèces) - Hesperiidae Latreille, 1809 (570 genres, 4113 espèces) - Heterobathmiidae Kristensen & Nielsen, 1979 (1 genre, 3 espèces) - Heterogynidae Rambur, 1866 (1 genre, 10 espèces) - Himantopteridae Rogenhofer, 1884 (11 genres, 80 espèces) — inclut les ex-Anomoeotidae. - Hyblaeidae Hampson, 1903 (2 genres, 18 espèces) - Immidae Common, 1979 (6 genres, 245 espèces) - Incurvariidae Spuler, 1898 (11 genres, 51 espèces) - Lacturidae Heppner, 1995 (8 genres, 120 espèces) - Lasiocampidae Harris, 1841 (224 genres, 1952 espèces) - Lecithoceridae Le Marchand, 1947 (100 genres, 1200 espèces) - Limacodidae Duponchel, 1845 (301 genres, 1672 espèces) - Lophocoronidae Common, 1973 (1 genre, 6 espèces) - Lycaenidae Leach, 1815 (416 genres, 5201 espèces) - Lyonetiidae Stainton, 1854 (32 genres, 204 espèces) - Lypusidae Herrich-Schäffer, 1857 (3 genres, 21 espèces) — inclut les ex-Chimabachidae. - Megalopygidae Herrich-Schäffer, 1855 (23 genres, 232 espèces) - †Mesokristenseniidae Huang, Nel & Minet, 2010 (1 genre, 3 espèces) - Metarbelidae Strand, 1909 (18 genres, 196 espèces) - Micropterigidae Herrich-Schäffer, 1855 (21 genres, 160 espèces) - Millieriidae Heppner, 1982 (3 genres, 4 espèces) - Mimallonidae Burmeister, 1878 (27 genres, 194 espèces) - Mnesarchaeidae Eyer, 1924 (1 genre, 7 espèces) - Momphidae Herrich-Schäffer, 1857 (6 genres, 115 espèces) - Neopseustidae Hering, 1925 (4 genres, 14 espèces) - Neotheoridae Kristensen, 1978 (1 genre, 1 espèce) - Nepticulidae Stainton, 1854 (13 genres, 819 espèces) - Noctuidae Latreille, 1809 (1089 genres, 11772 espèces) - Nolidae Bruand, 1847 (186 genres, 1738 espèces) - Notodontidae Stephens, 1829 (704 genres, 3800 espèces) - Nymphalidae Rafinesque, 1815 (559 genres, 6152 espèces) - Oecophoridae Bruand, 1850 (313 genres, 3308 espèces) - Oenosandridae Miller, 1991 (4 genres, 8 espèces) - Opostegidae Meyrick, 1893 (7 genres, 192 espèces) - Palaeosetidae Turner, 1922 (4 genres, 9 espèces) - Palaephatidae Davis, 1986 (7 genres, 57 espèces) - Papilionidae Latreille, 1802 (32 genres, 570 espèces) - Phaudidae Kirby, 1892 (3 genres, 15 espèces) - Phiditiidae Minet, 1994 (4 genres, 23 espèces) - Pieridae Swainson, 1820 (91 genres, 1164 espèces) - Plutellidae Guenée, 1845 (48 genres, 150 espèces) - Praydidae Moriuti, 1977 (3 genres, 47 espèces) - Prodidactidae Epstein & Brown, 2003 (1 genre, 1 espèce) - Prodoxidae Riley, 1881 (9 genres, 98 espèces) - Prototheoridae Meyrick, 1917 (1 genre, 12 espèces) - Pseudobistonidae Minet, Rajaei & Stüning, 2015 (2 genres, 2 espèces) - Psychidae Boisduval, 1829 (241 genres, 1350 espèces) — inclut les ex-Arrhenophanidae - Pterolonchidae Meyrick, 1918 (2 genres, 8 espèces) - Pterophoridae Latreille, 1802 (90 genres, 1318 espèces) - Pyralidae Latreille, 1809 (1055 genres, 5921 espèces) - Ratardidae Hampson, 1898 (3 genres, 10 espèces) - Riodinidae Grote, 1895 (146 genres, 1532 espèces) - Roeslerstammiidae Bruand, 1850 (13 genres, 53 espèces) - Saturniidae Boisduval, 1837 (169 genres, 2349 espèces) - Schistonoeidae Hodges, 1998 (1 genre, 1 espèce) - Schreckensteiniidae Fletcher, 1929 (2 genres, 8 espèces) - Scythrididae Rebel, 1901 (30 genres, 669 espèces) - Scythropiidae Friese, 1966 - Sematuridae Guenée,1858 (6 genres, 40 espèces) - Sesiidae Boisduval, 1828 (154 genres, 1397 espèces) - Simaethistidae Minet, 1991 (2 genres, 4 espèces) - Somabrachyidae Hampson, 1920 (4 genres, 8 espèces) - Sphingidae Latreille, 1802 (206 genres, 1463 espèces) - Stathmopodidae Janse, 1917 (44 genres, 408 espèces) - Thyrididae Herrich-Schäffer, 1846 (93 genres, 940 espèces) - Tineidae Latreille, 1810 (357 genres, 2393 espèces) — inclut les ex-Acrolophidae - Tineodidae Meyrick, 1885 (12 genres, 19 espèces) - Tischeriidae Spuler, 1898 (3 genres, 110 espèces) - Tortricidae Latreille, 1802 (1071 genres, 10387 espèces) - †Undopterigidae Kozlov, 1988 (1 genre, 1 espèce) - Uraniidae Leach, 1815 (90 genres, 686 espèces) - Urodidae Kyrki, 1988 (3 genres, 66 espèces) - Whalleyanidae Minet, 1991 (1 genre, 2 espèces) - Xyloryctidae Meyrick, 1890 (60 genres, 524 espèces) - Yponomeutidae Stephens, 1829 (95 genres, 363 espèces) - Ypsolophidae Guenée, 1845 (7 genres, 163 espèces) - Zygaenidae Latreille, 1809 (170 genres, 1036 espèces)
Écologie et répartition
Ils sont présents partout dans le monde, mais chaque papillon a une aire de distribution qui lui est spécifique. Certaines espèces sont sédentaires, d'autres se disséminent, d'autres encore sont migratrices sur des distances plus ou moins longues.

Disparition et papillons comme bioindicateurs
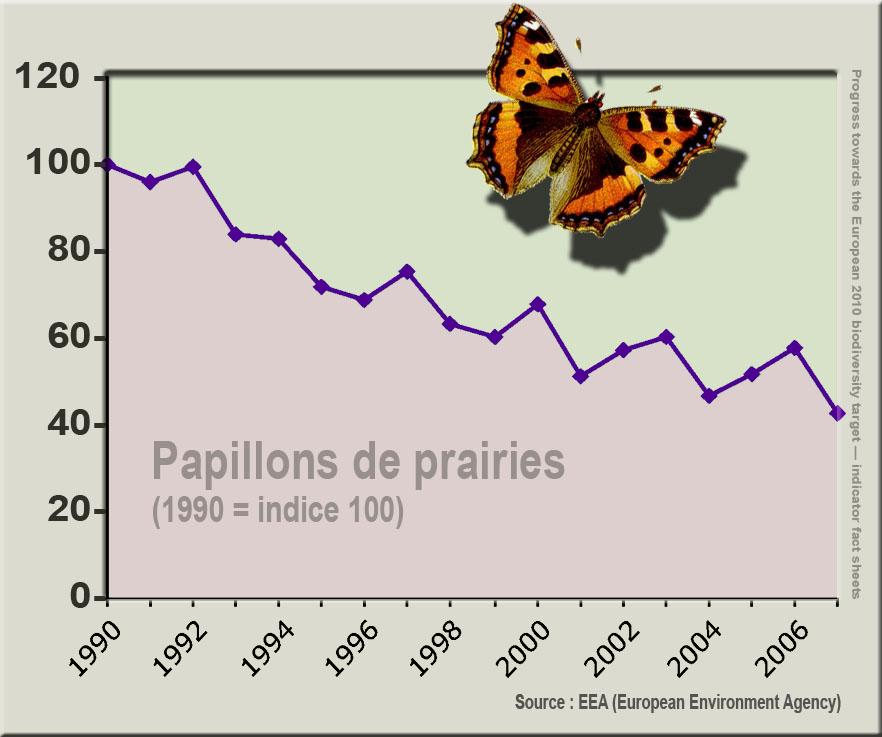
Les papillons sont présents dans presque tous les environnements terrestres (hors zones très froides). Ils y représentent près de 10 % des 1450000 espèces d'insectes connues à la surface de la Terre, derrière les coléoptères (25 %). Assez facile à observer, les papillons diurnes sont les espèces d'insectes (hors espèces-nuisibles) les mieux connues et suivies au monde. Très divers en termes d'exigences écologiques et souvent associés à une ou quelques espèces de plantes ou à un type d'habitat (la plupart des espèces sont monophages ou oligophages et étroitement inféodées à des plantes-hôtes sensibles et vulnérables) ils sont d'excellents indicateurs biologiques). Ils sont vulnérables à de nombreux facteurs de dégradation de l'environnement et sont des pollinisateurs, ce qui en fait d'intéressants bioindicateurs. En Europe notamment on les utilise pour évaluer l'état et la santé des écosystèmes, l'état de certains services écosystémiques qui sont des ressources (et des indicateurs) important pour les questions de soutenabilité du développement. Rien qu'au Royaume-Uni, il a été parcouru environ 750000 km (l'équivalent d'un aller-retour terre-lune) pour réaliser des transects répétées d'échantillonnages de Lépidoptères depuis 1976. Ces comptages ont permis de documenter les phénomènes de déclin et d'extinctions régionales et nationales, qui ont commencé avant 1900 (des inventaires des papillons butinant sur la pimprenelle étaient déjà fait en 1840 dans une zone protégée de Bavière en Allemagne). Partout, les résultats révèlent de graves pertes d'espèces en montrant que les espèces rares et spécialisées sont celles qui ont largement disparu et avant les autres, laissant des écosystèmes appauvris et dominés par quelques espèces communes et plus généralistes. La disparition des papillons ne cesse de s'accélérer depuis quelques décennies. Elle en dit donc long sur l’état de santé de l’environnement : ainsi un rapport de l'Agence européenne de l'environnement alerte sur le fait qu'en France comme en Europe, les papillons des prairies ont régressé de 50 % entre 1990 et 2011, principalement en raison de la dégradation progressive des écosystèmes, de l'agriculture intensive (pesticides) ou encore du réchauffement climatique. En Grande-Bretagne, environ 70 % de la totalité des espèces de papillons auraient ainsi disparu en vingt ans. La disparition des papillons, comme celle des abeilles et d'autres pollinisateurs) dans tout ou partie de leur aire de répartition, est en partie liée aux pesticides (désherbants qui tuent certaines de leurs plantes-hôtes, et insecticides, y compris depuis peu des insecticides dits biologiques produits à partir du bacille de thuringe (Bacillus thuringiensis ou Bt), très utilisés et ciblant les Lépidoptères, devenant une nouvelle et importante cause de disparition). Leur régression est aussi en partie causée par la réduction de la biodiversité florale du fait de la monoculture et de la transformation du paysage végétal par l'homme, qui a ainsi réduit la quantité des ressources alimentaires et leur diversité qualitative.
État, pressions, menaces
Quelques espèces, peu nombreuses, ont une aire en extension, voire un comportement invasif lié à l'extension de certaines cultures, comme c'est le cas de la pyrale du maïs, ou encore de la mineuse du marronnier, pour des raisons mal comprises ; mais de nombreuses espèces de Lépidoptères sont en forte régression ou ont récemment disparu de tout ou partie de leurs habitats naturels. La destruction et la fragmentation de leurs habitats (notamment par l'agriculture intensive, l'urbanisation, la déforestation, l'assèchement des milieux humides, les gyrobroyages) et l'usage croissant de pesticides semblent être les principales causes de cette régression ; les insecticides mais aussi les désherbants ciblent en effet les plantes-hôtes de certaines chenilles. Le dérèglement climatique est une autre cause, qui explique aussi des changements rapides d'aires de répartition ou des disjonctions de cycles de vie. Les rhopalocères sont en forte voie de régression, depuis les années 1970 notamment, probablement en raison d'un usage croissant de pesticides insecticides, mais aussi à cause du recul du bocage, des prairies, en raison de la fragmentation écopaysagère croissante, par les routes notamment (le phénomène de roadkill touche aussi les papillons quand ils traversent les routes). En France métropolitaine, seules une quinzaine d'espèces sont protégées en 2012. Or au moins 16 papillons de jour sont menacés de disparition à court terme, alertent l'Union internationale pour la conservation de la nature, le Muséum national d'histoire naturelle et l'Office pour les insectes et leur environnement. 18 papillons sont quasi-menacés selon la dernière liste rouge des espèces menacées en France, et beaucoup d'autres sont en voie de régression, parmi 253 espèces. À titre d'exemple, l'Hespérie du barbon (non revu depuis plus de 10 ans, en 2012) a été récemment classée « en danger critique » en France, probablement victime de l'urbanisation, de la périurbanisation et de la fragmentation écopaysagère du littoral méditerranéen (roadkill). Le Mélibée inféodé aux prairies humides acides à molinie voit ses habitats (landes humides et tourbières notamment) détruits, drainés, amendés ou boisés ; il ne survit que dans quelques tourbières des Vosges ou du Jura, et est au bord de l'extinction. L'Azuré de la sanguisorbe régresse en raison de la destruction des prairies humides où vit la plante-hôte à laquelle il est inféodé (Sanguisorbe officinale). De plus, sa chenille est durant quelque temps protégée dans une fourmilière. Par exemple l'hermite, un papillon autrefois largement répandu en France, a subi une régression de ses effectifs de l’ordre de 30 % rien que sur les 10 dernières années, ce qui le classe dans la catégorie « vulnérable ». L'Azuré du mélilot est lui classé « quasi menacé », alors que le mélilot est une plante abondante sur de nombreuses friches. Les éclairages nocturnes forment des remparts infranchissables pour de nombreuses espèces de papillons de nuit (Phototropisme négatif) qui ont besoin de se déplacer entre leurs zones de reproduction et nourrissage, et pour leurs migrations, bon nombre d'entre eux meurt d'épuisement en s'approchant de ces éclairages qui, dans ce cas, deviennent un piège dont ils ne sortiront plus (Phototropisme positif). Les Lépidoptères nocturnes sont majoritaires par rapport aux diurnes et participent grandement à la pollinisation parfois de façon spécifique, ils sont aussi la source alimentaire quasiment exclusive des Chiroptères qui sont, eux aussi, en grand danger.
Méthodes de conservation
Le taux d’extinction des insectes et arthropodes en zones tempérées excède actuellement le taux d’extinction des vertébrés et des plantes vasculaires. Leur conservation est d’autant plus nécessaire puisque les extinctions de populations ont même parfois lieu dans des réserves naturelles, alors qu’on y retrouve des ressources en abondance. Étant donné les fortes pressions et menaces que subissent le lépidoptère partout dans le monde liées à la perte d’habitats, des mesures de conservation doivent être envisagées par les groupes de protection de la biodiversité. Par ailleurs, plusieurs auteurs soutiennent qu’il est peu probable que les espèces de lépidoptères en voie de disparition puissent survivre sans adaptation de leur habitat. L’importance du lépidoptère au sein d’un écosystème n’est pas négligeable, puisqu’il s’agit entre autres d’une espèce pollinisatrice. Au Canada, le registre public des espèces en péril dénombre deux papillons désignés en voie de disparition ou en péril, soit le Satyre fauve des Maritimes (Coenonympha nipisiquit), endémique à la région de la baie des Chaleurs au Québec, et le Monarque (Danaus plexippus), présent du Canada au Mexique, en passant par la Californie. Ces espèces doivent faire l’objet de projet de conservation afin de préserver la biodiversité locale des écosystèmes urbains ou sujets à des changements importants dus aux changements climatiques étant donné leur statut. Plusieurs approches ont été développées par les gestionnaires de milieux naturels au cours des dernières années en fonction des menaces qui pèsent sur les populations de lépidoptères. Il existe d’ailleurs des plans de conservation qui sont destinés aux décideurs politiques pour favoriser la conservation des lépidoptères en zones urbaines. Par exemple, la fondation David Suzuki rend disponible un plan de conservation pour le monarque en milieu urbain au Canada. Or, peu d’études ont été réalisées afin de déterminer leur efficacité à long et court terme sur la démographie, le comportement et la viabilité de la population. La viabilité d’une métapopulation exprime la probabilité qu’elle persiste pour un temps donné. Pourtant, les tentatives de conservation d’espèces de papillons s’avèrent souvent infructueuses en raison d’une mauvaise compréhension des causes du déclin de leur population. Entre autres, la préservation de l’écosystème primaire, malgré qu’elle consiste en une approche bénéfique pour plusieurs espèces, n’est pas toujours adaptée à la conservation des insectes. Une identification des causes du déclin et l’élimination de ces causes est donc primordiale pour élaborer un plan de conservation réussi. D’abord, un suivi des populations de papillons, notamment des espèces à statut, est nécessaire dans une optique de conservation. Dans les paysages fragmentés, la notion de métapopulation devient pertinente pour assurer l’efficacité du plan de conservation. En effet, des populations locales de lépidoptères peuvent se disperser vers d’autres habitats en passant par des zones qui ne sont pas appropriées pour leur survie au cours de leur cycle de vie. Des habitats connectés physiquement ne sont pas toujours nécessaires, même en zone urbaine. Par contre, la présence d’habitats viables en zone urbaine est primordiale pour le maintien de la biodiversité urbaine. Les habitats peuvent être « connectés » par le biais de l’intervention humaine. En revanche, des connexions structurelles ou fonctionnelles entre les habitats par le biais des corridors écosystémiques favorise ce type de dispersion. Des écosystèmes ruraux ou urbains permettant les échanges entre les populations favorisent une diversité génétique et une recolonisation des habitats qui ont subi une extinction locale, ce qui protège la métapopulation de l’extinction. De manière générale, la perte d’habitat ou leur fragmentation affecte la ténacité des populations de papillons et peuvent entraîner leur extinction, en les rendant plus vulnérables aux perturbations locales. De petits habitats fragmentés peuvent être convenables pour une métapopulation, si on s’assure de leur connexion (humaine ou naturelle) et de leur quantité. En effet, il faut considérer une quantité minimale d’habitats convenables pour qu’une métapopulation puisse survivre. Comme les conditions locales entre les habitats fragmentés divergent, on diminue le risque d’extinction des métapopulations. Comme la gestion de la conservation d’un habitat pour une espèce de papillons nécessite une bonne compréhension des menaces, il est possible que la simulation de mécanismes clés de perturbation soit nécessaire. Les interventions humaines pour maintenir ou créer une connectivité pourraient donc inclure une perturbation de l’habitat. Par exemple, il est possible que le retrait des plantes indigènes ou de plantes exotiques envahissantes soit essentiel au maintien des plantes nourricières pour le papillon. Un autre exemple serait de recréer des dynamiques de feu pour maintenir le stade de succession végétale à une succession primaire, , qui favorise la présence de plantes idéales pour les larves et la ponte. Par contre, le feu favorise la croissance d’espèces végétales envahissantes à la suite de la perturbation, et ne peut par conséquent pas constituer en elle seule une méthode de réhabilitation du papillon dans les prairies sans la combiner à de la revégétalisation. Par contre, le retrait des espèces envahissantes doit être accompagné d’une revégétalisation du site avec des espèces indigènes, accompagné d’un suivi sur plusieurs années pour s’assurer que la colonie a pu être éradiquée. Un stade succession primaire implique également des sols plus jeunes, une augmentation de la luminosité disponible pour les graminées ainsi qu’une augmentation de l’accessibilité des lépidoptères aux plantes qui leur sont vitales en retirant les arbustes. D’autres interventions pourraient s’avérer nécessaires pour soutenir une espèce menacée dans le cadre de la mise en place d’un plan de conservation, telles que la restauration des habitats fragmentés. Par contre, il est démontré que l’amélioration de l’habitat n’est pas suffisante pour les populations isolées de lépidoptères. La création de nouveaux habitats ou l’agrandissement d’habitats existants, ainsi que la connectivité entre les habitats fragmentés est nécessaire, , combiné avec d’autres méthodes de gestion comme la réintroduction d’individus ou l’adaptation de l’habitat aux stades du cycle de vie de l’espèce menacée. Une restauration d’habitat implique d’améliorer sa qualité pour une ou plusieurs espèces. Une des méthodes pour améliorer la qualité de l’habitat pour le papillon est d’instaurer sur le long terme un régime approprié de broutage, de tonte ou de fauchage afin d’y maintenir une structure de végétation basse et ouverte. L’efficacité de cette méthode pour contrôler les espèces envahissantes est variable, mais elle peut tout de même avoir des effets bénéfiques pour les populations de lépidoptères dont l’habitat est dominé par la végétation ligneuse. Cette structure de végétation permet à certaines plantes, comme le Succisa pratensis, de développer des feuilles plus larges, ce qui attire les femelles pour la ponte des œufs puisque le risque de manque de nourriture pour les larves est réduit. Il a été démontré que la tonte des graminées est associée à une augmentation de la taille de la population, notamment chez le lcaricia icarioides fenderi, ainsi qu’à un plus grand nombre d'œufs et une augmentation du taux de survie des larves. Un habitat où la succession végétale n’est pas suivie peut ne pas adapté à tous les stades du cycle de vie de l’espèce ce qui réduit la viabilité des métapopulations de lépidoptères. Ensuite, la dynamique de la métapopulation doit être prise en compte dans un plan de gestion et de conservation d’une espèce de lépidoptères. En effet, la métapopulation doit avoir une taille minimale que l’espèce soit viable en termes de diversité génétique et de protection contre les maladies qui peuvent les atteindre. Une analyse de la viabilité de la population peut être un outil pertinent, puisqu’il permet de prédire le risque d’extinction ou la viabilité d’une population en fonction de certains paramètres. Ce type de modélisation de la démographie amène à l’identification des facteurs qui contribuent à la survie du lépidoptère, et finalement au choix de la méthode de gestion de son habitat. L’analyse de viabilité permet de prendre en compte les dynamiques des paysages dans la gestion de la conservation à long terme pour un habitat fragmenté ayant un stade de succession végétale avancé. Les mesures de conservation choisies pour une espèce doivent prendre en compte les différents stades de son cycle de vie et du développement du lépidoptère. Il faut souligner que le risque d’adapter un habitat aux premiers stades du cycle de vie du papillon en perturbant l’habitat dans lequel il se trouve est souvent bénéfique finalement pour la survie de la métapopulation. En effet, même si les stades juvéniles et les sites de pontes ne nécessitent qu’une petite partie des ressources que le papillon utilise à maturité, il ne faut pas négliger leur importance dans la mise en place du plan de conservation. La survie des larves et la présence des sites de ponte ont notamment un effet direct sur la taille de la métapopulation et sa persistance. Le plan de restauration d’un habitat devrait en définitive représenter toutes les étapes de vie du lépidoptère. Pour ce qui est du choix de l’habitat à conserver pour favoriser une population de lépidoptères ou bien le choix de l’habitat dans lequel il y aura une réintroduction de l’espèce, il est nécessaire de comprendre le besoin de l’habitat à toutes les échelles. À petite échelle, il faut considérer les plantes présentes ainsi que les dynamiques locales, dont les variations microclimatiques et topographiques. Même si elles ne sont pas souvent prises en compte, ces variations peuvent avoir un effet considérable sur la survie de la métapopulation, puisqu’elles peuvent affecter le comportement des individus dans un habitat qui semble adapté à première vue. À grande échelle, il est important de prendre en considération le type d’écosystème ainsi que la distribution historique de l’espèce. En effet, leur distribution actuelle ne correspond pas nécessairement au meilleur habitat possible historiquement. La modélisation est nécessaire avant de choisir un habitat pour la réintroduction afin de bien prioriser les stades du cycle de vie les plus menacés en fonction des caractéristiques d’habitats disponibles. Le plan de restauration devrait prendre en considération l’ensemble des facteurs biotiques et abiotiques de l’écosystème de prédilection de l’espèce faisant l’objet de la réintroduction. Les critères de sélections pour le choix de l’habitat comprennent la présence des plantes vitales pour l’espèce faisant l’objet du plan de conservation, une pente maximale préférable pour l’espèce ainsi qu’une proportion d’espèces végétales indigène plus grande que la quantité d’espèces exotiques présentes dans le paysage. Comme les plantes nécessaires pour la survie des lépidoptères à différents stades de leur cycle de vie sont pour la plupart en déclin, il est souvent nécessaire de revaloriser cette végétation au sein de l’habitat dans le plan de conservation. Dans le cadre d’une restauration ou de création d’habitats, il est nécessaire de recréer une communauté végétale diversifiée, biologiquement cohérente et fonctionnelle: la seule plantation de plantes vitales pour l’espèce faisant l’objet du plan de conservation ne sera pas suffisante pour recréer les interactions complexes que l’on retrouve dans l’écosystème à l’état naturel. Afin de planifier cette recoloniastion, il faut prendre en compte la distribution historique des communautés végétales pour l’habitat en question et de les adapter en fonction des réalités terrains, des changements climatiques qui ont eu lieu depuis les premières prises de données, en plus de prendre en compte la biologie du lépidoptère. Les parcelles d’habitat non perturbés devraient être intégrées dans le plan de conservation afin de retrouver un habitat restauré cohérent et qui est adapté à tous les niveaux trophiques. Finalement, les habitats fragmentés doivent avoir une assez grande superficie pour accueillir la population locale, ce qui permet de soutenir une métapopulation viable. Il est par ailleurs essentiel, lors d’une modification ou d’une création d’un habitat dans le cadre d’un plan de conservation, que cette adaptation permette de soutenir autant d’espèces que possible, en particulier dans les points chauds de biodiversité, ou bien dans des zones où l’on retrouve une population dense d’espèces endémiques ou rares. Sans la considération des autres espèces dans un plan d’action visant la conservation d’une espèce de lépidoptères en particulier, des effets négatifs sur la biodiversité sont attendus, en plus d’une dégradation du statut des espèces endémiques ou rares vulnérables qui fréquentent cet écosystème. La méthode de la réintroduction d’individus dans un habitat donné peut être nécessaire dans un contexte d’extinction imminente d’une population de lépidoptères, dans une zone où la recolonisation naturelle est peu probable étant donnée l’isolement géographique des populations par rapport aux parcelles viables. Cette technique de conservation a été réalisée pour plusieurs espèces dont le Glaucopsyche lygdamus palosverdesensis aux États-Unis et le Coenonympha nipisiquit au Canada. Deux avenues peuvent être empruntées dans le cadre de cette méthode de gestion d’une population. La première est de fournir aux populations introduites des habitats garantissant un succès d’intégration. La seconde approche consiste à modifier graduellement les communautés végétales de l’habitat dans lequel le papillon est introduit, ce qui permet à la population de s’adapter et à la végétation de prendre place de façon graduelle. La première approche nécessite une gestion intensive et continue afin de permettre à la population de persister dans son nouvel habitat. Elle assure toutefois une viabilité à court terme pour la population de lépidoptères introduite et limite les risques d’extinction subite, ce qui peut être nécessaire lors d’une implantation. La deuxième approche prévoit de moins en moins d’intervention humaine avec le temps puisque la population s’adapte au milieu en fonction des réalités présentes et est par conséquent plus adaptée à une planification à long terme. Il ne faut pas sous-estimer l’importance de faire un suivi de la viabilité de la population réintroduite ou conservée sur le à plusieurs échelles de temps. Il arrive qu’un habitat soit considéré comme étant idéal pour l’espèce par les experts (par exemple, un habitat qui contient plusieurs plantes nécessaires aux larves) alors qu’il ne l’est pas sur le temps long à cause, par exemple, d’extinctions locales fréquentes. La réintroduction peut donc être une réussite à court terme sans l’être une autre échelle de temps. Le travail à faire pour que les espèces de lépidoptères menacées retrouvent un statut stable pour chacune des populations reste colossal. Par contre les plans de conservation doivent s’ajuster à une multitude de critères pour s’adapter à la métapopulation de l’espèce faisant l’objet d’un plan de conservation. Les techniques de restauration d’habitats et de populations de lépidoptères détaillées dans les différentes études ne peuvent pas être universelles. Pour qu’elles soient applicables à l’ensemble des espèces de lépidoptères dans différents types d’habitats, la gestion de la conservation des espèces devrait se concentrer sur les processus écologiques comme les perturbations historiquement bénéfiques pour le maintien des métapopulations de papillons ou la compétition entre espèces. Or, la plupart des plans de conservation se penche plutôt vers l’analyse des objectifs spécifiques au site, ce qui demande plus de travail pour bâtir un projet dans une zone différente avec une espèce différente. Aussi, un plan de gestion devrait être flexible et s’adapter en fonction des avancées scientifiques par rapport aux connaissances biologiques de l’espèce de lépidoptères faisant l’objet d’une conservation ou de l’écologie du paysage, des changements climatiques et des dynamiques naturelles de l’habitat. Il est possible que les objectifs et les mesures entreprises pour y arriver soient appelés à être modifiés dans le temps et le plan de gestion devrait prendre ces facteurs en compte.

Protection
La convention de Berne qui a pour but d'assurer la conservation de la vie sauvage et du milieu naturel de l'Europe par une coopération entre les États a été signée le 19 septembre 1979 à Berne en Suisse (entrée en vigueur le juin 1982). Elle comporte en annexe une liste d'espèces qui comprend des papillons. Voici quelques exemples : Une espèce est considérée comme nuisible Cacyreus marshalli le brun des pelargonium. Des recommandations sont émises au niveau national en direction des Maires et Mairies qui convie à réduire voir éteindre quant cela est possible les éclairages nocturnes ayant pas ou peut d'utilité publique pour rétablir les Corridor biologique, Les ultraviolets sont particulièrement à proscrire des éclairages nocturnes, un label et décerné aux communes sous la forme d'étoiles (communes étoilées) cette appellation concerne toutefois principalement la réappropriation du ciel nocturne, la redécouverte de la voute céleste. - Polyommatus golgus - Euphydryas aurinia le damier de la succise - Euphydryas maturna le damier du frêne - Papilio alexanor Alexanor - Papilio hospiton Porte-Queue de Corse - Parnassius apollo Apollon - Parnassius mnemosyne - Directive habitats de la communauté européenne du 21 mai 1992 : Annexe II - Lycaena helle – Cuivré de la bistorte - Lycaena dispar — Cuivré des marais - Polyommatus eroides - Polyommatus golgus - Phengaris teleius- l'azuré de la sanguisorbe - Coenonympha oedippus le fadet des laîches - Euphydryas aurinia le damier de la succise - Directive habitats de la communauté européenne du 21 mai 1992 : Annexe IV espèces nécessitant une protection stricte, transposé en droit français par l'arrêté du 23 avril 2007 remplaçant celui du 22 juillet 1993 - Lycaena helle - Cuivré de la bistorte - Lycaena dispar — Cuivré des marais - Phengaris arion- l'azuré du serpolet - Phengaris nausithous- l'azuré des palluds - Phengaris teleius- l'azuré de la sanguisorbe - Polyommatus eroides - Polyommatus golgus - Lopinga achine Bacchante - Coenonympha oedippus le fadet des laîches - Euphydryas aurinia le damier de la succise - Protection nationale par arrêté du 23 avril 2007 - Phengaris alcon- l'azuré des mouillères - Phengaris rebeli- l'azuré de la croisette. - Protection régionale, par exemple - Cupido minimus, Cyaniris semiargus, Lysandra coridon et Melitaea phoebe en Poitou-Charentes - Satyrium w-album la thécla de l'orme, Glaucopsyche alexis l'azuré des cytises, Plebejus idasle moyen argus, Plebejus idas l'azuré des coronilles, Pseudophilotes baton l'azuré du thym, en Île-de-France.
Symboles et mythologie du papillon
Début juillet 1608, les faubourgs d'Aix-en-Provence furent recouverts d'une pluie de sang. Nicolas-Claude Fabri de Peiresc fit des relevés de cette pluie en recueillant quelques gouttes sur la muraille du cimetière de la cathédrale. Il découvrit que c'étaient les excréments des chrysalides des papillons qui avaient été observés récemment. Le centre-ville n'ayant pas été envahi, il était resté épargné. Cette explication scientifique ne calma pas la terreur populaire. Grâce et légèreté, le papillon est, au Japon, un emblème de la femme ; et deux papillons figurent le bonheur conjugal. Légèreté subtile : les papillons sont des esprits voyageurs ; leur vue annonce une visite, ou la mort d’un proche. Un autre aspect du symbolisme du papillon est fondé sur ses métamorphoses : la chrysalide est l’œuf qui contient la potentialité de l’être ; le papillon qui en sort est un symbole de résurrection. C’est encore, si l’on préfère la sortie du tombeau. Symbole du feu solaire et diurne, et pour cette raison de l’âme des guerriers, il représente le soleil dans le temple des guerriers aztèques et le dieu de feu porte comme emblème un pectoral nommé papillon d’obsidienne. L’obsidienne, comme le silex, est une pierre de feu. Toutes ces interprétations découlent probablement de l’association analogique du papillon et de la flamme, du fait de ses couleurs et du battement de ses ailes. Dans la mythologie grecque, Psyché (l'âme), mariée à Éros (l'amour), acquiert des ailes de papillon ; la peinture française, nourrie de mythologie, fait figurer des papillons à côté de Psyché dans les tableaux qui la représentent. En grec ancien, psukhê signifie à la fois « âme » et « papillon ».

Dessins et peintures
Les papillons ont été représentés et il en reste des peintures datant pour la plus ancienne, en Égypte dans la tombe de Neferhotep de vers 3000 ans avant notre ère. En Europe, les plus anciennes peintures de papillons retrouvées sont celles d'enluminures du, puis dans divers tableaux de la peinture flamande, de la peinture hollandaise et de la peinture italienne mais ils sont particulièrement présents dans les natures mortes flamandes et hollandaises du.
Autres représentations de papillons
De très nombreux papillons ont fait l'objet de tirages dans de nombreux pays. - En philatélie